порядковому номеру элемента
относительной атомной массе
2.Ряд химических элементов, в котором усиливаются металлические свойства соответствующих им простых веществ
натрий – магний – алюминий
углерод – кремний – германий
сурьма – мышьяк – фосфор
селен – сера – хлор
3. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
вода и сероводород
бромид калия и азот
аммиак и водород
кислород и метан
4. Хлор проявляет высшую возможную степень окисления в соединении
5.Вещества, формулы которых Ca3(PO4)2 и Na2O, являются соответственно
кислотой и оснόвным оксидом
солью и амфотерным гидроксидом
солью и основным оксидом
оснόвным оксидом и основанием
6. Признаком протекания химической реакции между хлоридом меди (II) и гидроксидом калия является
7. Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль
8. Необратимо протекает реакция ионного обмена между растворами
хлорида аммония и нитрата калия
сульфата натрия и карбоната калия
хлорида бария и серной кислотой
гидроксида натрия и хлорида бария
Составитель: Цыренова Р.В.
9. Цинк реагирует с
10. С оксидом кальция взаимодействует каждое из двух веществ:
11. Раствор гидроксида калия реагирует с каждым из двух веществ:
12. Раствор нитрата меди (II) не реагирует с (со)
13.Верны ли суждения о химическом загрязнении окружающей среды и его последствиях?
А. Повышенное содержание в атмосфере оксида углерода(II) не является угрожающим
фактором для здоровья человека.
Б. Производство цемента и других строительных материалов не относят к источникам
верны оба суждения
оба суждения неверны
14. Элемент углерод является восстановителем в реакции
CO + 3H2 = CH4 + H2O
CO2 + MgO = MgCO3
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата железа(II)
Составитель: Цыренова Р.В.
16. Для ряда химических элементов бор → углерод → азот → кислород характерны следующие закономерности:
увеличивается число электронов во внешнем электронном слое
увеличивается радиус атомов
усиливаются неметаллические свойства простых веществ
ослабевает кислотный характер высших оксидов
17. Для этана верны следующие утверждения:
при комнатной температуре является газом
является непредельным углеводородом
атомы углерода в молекуле соединены двойной связью
характерны реакции замещения
сгорает с образованием угарного газа и водорода
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА РЕАКТИВ
А) СаCO3 и CaSiO3 1) ВаCl2
Б) р-рNaCl и р-рNaBr 2) H2SO4
В) р-р Na2SO4 и р-рNaNO3 3) AgNO3
19. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию.

Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества протонов и нейтронов (общепринятое название для которых – нуклоны), связанных между собой ядерными силами.
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He2 / 2He.
Количество нейтронов соответствует определённому изотопу того или иного элемента. Изотопы – это элементы с одинаковым атомным номером (одинаковым количеством протонов и электронов), но с разным массовым числом. Массовое число – общее количество нейтронов и протонов в ядре атома (обозначается латинской буквой А). При записи формул массовое число указывается вверху символа элемента с одной из сторон: He 4 2/ 4 2He (Изотоп Гелия – Гелий – 4)
Таким образом, чтобы узнать число нейтронов в том или ином изотопе, следует от общего массового числа отнять число протонов. Например, нам известно, что в атоме Гелия-4 He 4 2 cодержится 4 элементарные частицы, так как массовое число изотопа – 4 . При этом нам известно, что He 4 2 меет 2 протона. Отняв от 4 (общее массовое число) 2 (кол-во протонов) получаем 2 – количество нейтронов в ядре Гелия-4.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He 4 2), ядро которого состоит из двух протонов и двух нейтронов. Поскольку ядро Гелия-4, именуемое альфа-частицей (α-частица) обладает наибольшей эффективностью в ядерных реакциях, его часто используют для экспериментов в этом направлении. Стоит отметить, что в формулах ядерных реакций зачастую вместо He 4 2 используется символ α.
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He 4 2) «бомбардировались» ядра изотопа азота (N 14 7), вследствие чего образовался изотоп оксигена (O 17 8) и один протон (p 1 1)
Данная ядерная реакция выглядит следующим образом:
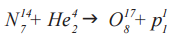
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
Шаг 1. Посчитать количество нейтронов и протонов в каждом ядре:
– количество протонов указано в нижнем показателе;
– количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
– умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
– умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
– сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
– сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
– сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He 4 2), провёденная Э. Резерфордом в 1919 году)
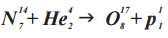
ДО РЕАКЦИИ (N 14 7 + He 4 2)
N 14 7
Количество протонов: 7
Количество нейтронов: 14-7 = 7
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He 4 2
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количество фантомных частичек По в ядре: 24+66 = 90
Итого, количество фантомных частичек По до реакции
N 14 7 + He 4 2
315 + 90 = 405
ПОСЛЕ РЕАКЦИИ (O 17 8) и один протон (p 1 1):
O 17 8
Количество протонов: 8
Количество нейтронов: 17-8 = 9
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 8 протонах: (12 х 8) = 96
в 1 нейтроне – 33 По, значит в 9 нейтронах: (9 х 33) = 297
Общее количество фантомных частичек По в ядре: 96+297 = 393
p 1 1
Количество протонов: 1
Количество нейтронов: 1-1=0
Количество фантомных частичек По:
В 1 протоне – 12 По
Нейтроны отсутствуют.
Общее количество фантомных частичек По в ядре: 12
Итого, количество фантомных частичек По после реакции
(O 17 8 + p 1 1):
393 + 12 = 405
Сравним количество фантомных частичек По до и после реакции:
| До реакции | После реакции |
| 405 | 405 |
Количества фантомных частичек По до и после реакции равны.
ПРИМЕР СОКРАЩЁННОЙ ФОРМЫ ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДЕРНОЙ РЕАКЦИИ.
Здесь и далее расчёты количества фантомных частичек По приведены в сокращённой форме, в которой отображено общее количество фантомных частичек По в каждом ядре, а также их сумма до и после реакции.
Известной ядерной реакцией является реакция взаимодействия α-частиц с изотопом бериллия, прикоторой впервые был обнаружен нейтрон, проявивший себя как самостоятельная частица в результате ядерного преобразования. Данная реакция была осуществлена в 1932 году английским физиком Джеймсом Чедвиком. Формула реакции:
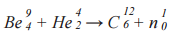
213 + 90 → 270 + 33 – количество фантомных частичек По в каждом из ядер
303 = 303 – общая сумма фантомных частичек По до и после реакции
Количества фантомных частичек По до и после реакции равны.
Ответ или решение 1
![]()
1) Na (натрий) имеет порядковый номер 11, значит в его ядре 11 протонов и 11 электронов, его Ar = 23, значит число нейтронов:
23 — 11 = 12.
Соответственно:
Р (фосфор) – протонов и электронов 15, а нейтронов 31— 15 = 16;
Au (золото) – протонов и электронов 79, нейтронов 197 — 79 = 118.
2) Порядковый номер 35 у элемента брома — Br. Значит, заряд ядра равен 35.
Это значит, что протонов и электронов— по 35, а нейтронов 80 — 35 = 45.